Основные типы химической связи
Из курса химии VIII класса вам известно, что атомы могут соединяться друг с другом с образованием как простых, так и сложных веществ. При этом возникают различного рода химические связи: ионная, ковалентная (неполярная и полярная), металлическая и водородная. Вспомним, что один из существующих показателей, определяющих, какая связь образуется между атомами – ионная или ковалентная, – это электроотрицательность, т.е. способность атомов притягивать к себе электроны от других атомов. При этом следует учесть, что эектроотрицательности атомов элементов изменяются постепенно. В периодах периодической системы слева направо численные значения электроотрицательностей возрастают, а в группах сверху вниз – уменьшаются. Так как тип связи зависит от разности значений электроотрицательностей соединяющихся атомов элементов, то провести резкую границу между отдельными типами химической связи нельзя. В зависимомти от того, к какому из предельных случаев химическая связь ближе по своему характеру, ее относят к ионной или ковалентной полярной.
Ионная связь. Ионная связь образуется при взаимодействии атомов, которые сильно различаются по электротрицательностям. Например, типичные металлы – литий Li, натрий Na, калий K, кальций Ca, стронций Sr, барий Ba – образуют ионную связь с типичными неметаллами, в основном с галогенами.
¢Следует учесть, что при взаимодействии даже щелочных металлов с такими электроотрицательными элементами, как кислород и сера, ионная связь в полном смысле этого понятия возникает. Так, например, в соединениях Li₂O, Na₂S существует не ионная, а ковалентная сильнополярная связь. _
Кроме галогенидов самых активных металлов, ионная связь характерна для щелочей и солей, в которые входят атомы кислорода и активных металлов. Например, в гидроксиде натрия NaOH и в сульфате натрия Na₂SO₄ ионными являются только связи между атомами натрия и кислорода. Остальные связи ковалентные полярные. В разбавленном водном растворе щелочи и соли диссоциируют так:
![]()
Между ионами существуют сильные электростатические силы притяжения. Поэтому ионные соединения обладают сравнительно высокими температурами плавления.
Ковалентная неполярная связь. При соединении атомов с одинаковыми электроотрицательностями образуются молекулы с ковален6тной неполярной связью. Вспомним, что такая связь, например, существует в молекулах газообразных веществ, состоящих из одинаковых атомов: H₂, F₂, Cl₂, O₂, N₂. В этих случаях химические связи образуются за счет общих электронных пар, т.е. при перекрывании соответствующих электронных облаков, обусловленном электронно-ядерным взаимодействием, которое осуществляется при сближении атомов.
Рассмотрим последовательность составления электронных формул веществ с ковалентной неполярной связью (на примере молекулы азота N₂).
Рисуют схему распределения электронов по энергетическим уровням и подуровням в атоме азота:
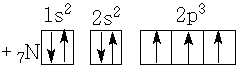
Отмечают, что в атоме азота имеется три неспаренных электрона, которые образуют между атомами азота три связывающие электронные пары:
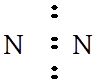
Оставшуюся на наружном электронном уровне электронную пару у каждого атома азота изображают в виде неподеленной:
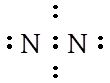
Приводя электронные формулы веществ, всегда необходимо помнить, что общая электронная пара, обозначаемая точками, представляет собой новое облако, образующееся при перекрывании соответствующих электронных облаков. В молекуле азота перекрываются p-электронные облака и образуется одна σ- и две π-связи. В данном случае образуется прочная тройная связь.
В отличие от взаимодействия ионов силы притяжения между отдельными нейтральными молекулами малы, поэтому вещества с ковалентной неполярной связью обладают низкими температурами плавления.
Ковалентная полярная связь. При взаимодействии атомов, электроотрицательности которых отличаются незначительно, происходит смещение общей связывающей электронной пары к более электроотрицательному атому и образуется ковалентная полярная связь.
Так как между полярными молекулами также существуют силы электростатического притяжения, то температуры плавления и кипения этих соединений гораздо выше, чем у веществ с ковалентной неполярной связью.
Еще по теме:
Психолого-педагогические аспекты детской игровой
деятельности
Игра - ведущая деятельность ребенка. Ее огромное значение в жизни детей побуждали многих ученых искать объяснения природы и происхождения этой удивительной детской деятельности. Существует много теорий детской игры. Теория исследует вопрос происхождения игры, то есть, почему и откуда возникла эта д ...
Понятие личности
ребенка в аспектах нормы
Сразу же следует оговорить, что сложность в определении понятия «норма» не только терминологическая, но и содержательная. Важно помнить, что норма – это некое идеальное образование, условное обозначение объективной реальности, некий среднестатистический показатель, характеризующий реальную действит ...
Методы и формы социально-педагогической работы с безнадзорными и
беспризорными детьми
Начало работы должно быть построено на сборе всей доступной информации о детях данной категории. Любая существующая информация будет неоценимой. Может потребоваться информация не только о детях, но и о работающих с ними Анализ этой информации был очень полезным в начале работы. Следующий этап- непо ...
Педагогика как наука

Обучение было и всегда будет, пока живет человечество. Можно сказать, что подготовка молодого поколения к участию в жизни общества путем передачи социального опыта есть неотъемлемая общественная функция во все времена и у всех народов.
Категории
- Главная
- Методы производственного обучения
- Новые технологии обучения
- Обучение чтению на начальном этапе
- Сущность воспитания
- Информатика и образование
- Формирование деятельности
- Карта сайта
