История развития оценочной системы
![]()
![]()
Таким образом, углерод проявляет валентность IV за счет распаривания 2S²-электронов и перехода одного из них на вакантную орбиталь. (Вакантный – незанятый, пустующий).
Периодическое изменение валентности и размеров атомов
Периодическое изменение валентности элементов и, следовательно, их свойств обусловлено тем, что с возрастанием зарядов ядер атомов периодически повторяются элементы со сходной электронной структурой, например литий Li, натрий Na и калий K; бериллий Be, магний Mg и т.д.
В периодической последовательности возрастают атомные радиусы этих элементов. Так, например, во 2 – ом периоде от элемента лития Li до элемента фтора F происходит постепенное уменьшение атомных радиусов, а от элемента фтора F к элементу натрию Na – резкое увеличение атомных радиусов. Объясняется это явление так.
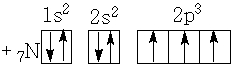
При переходе от лития Li к фтору F постепенно возрастают заряды ядер атомов этих элементов. В связи с этим в ряду постепенно увеличивается сила притяжения наружных электронов к ядру и размеры атомов уменьшаются. А с переходом от элемента фтора F к элементу натрию Na последующий электрон помещается на более удаленный от ядра третий энергетический уровень. Поэтому размеры атомов элемента натрия Na сильно возрастают.
Размеры атомов, в свою очередь, влияют на их свойства. Так, например, атомы элементов лития Li, натрия Na, калия K обладают наибольшими размерами по сравнению с атомами других элементов в тех же периодах. В связи с этим наружные электроны в атомах щелочных металлов находятся дальше от ядра, слабее притягиваются к нему и могут легко удаляться. Этим и объясняется, почему щелочные металлы являются донорами электронов, т.е. сильными восстановителями. При переходе в периодах от типичных металлических элементов к галогенам размеры атомов уменьшаются, сила притяжения наружных электронов к ядру увеличивается, что и приводит к уменьшению восстановительных и увеличению окислительных свойств.
В связи с периодическим изменением валентности химических элементов периодически изменяются также формы (состав, строение) и свойства оксидов и водородных соединений (гидридов) химических элементов. Так, например, оксид лития Li₂O, оксид натрия Na₂O, оксид калия K₂O сходны не только по составу и строению, но и по свойствам. Все они бурно реагируют с водой с образованием соответствующих оснований, обладающих сильнощелочными свойствами. Однако между этими оксидами имеются различия. От оксида лития к оксиду калия, т.е. группе сверху вниз, основные свойства оксидов усиливаются. Например, оксид калия образует сравнительно более сильную щелочь, чем оксид натрия.
Такая же закономерность наблюдается и в других группах. Так, например, высшие оксиды ІV группы главной подгруппы – оксид углерода (ІV) CO₂, оксид кремния (ІV) SiO₂, оксид германия GeO₂, оксид олова (ІV) SnO₂, оксид свинца PbO₂ – сходны по составу и по некоторым свойствам. Однако оксид углерода (ІV) и свинца (ІV) амфотерны – у них кислотные свойства выражены еще слабее.
Периодически изменяются также формы и свойства гидроксидов. Металлы I–III групп главных подгрупп с водородом образуют нелетучие водородные соединения. Так, например, гидрид лития LiH, гидрид натрия NaH, гидрид калия KH сходны между собой как по форме, так и по свойствам.
Элементы ІV – VІІ групп главных подгрупп образуют летучие водородные соединения. Формы и свойства этих соединений тоже изменяются периодически. Так, например, водородные соединения галогенов – фтороводород HF, хлороводород HCl, бромоводород HBr, иодоводород HI – сходны как по форме, так и по свойствам.
Еще по теме:
Семья как фактор формирования личности
Духовное богатство личности, ее взгляды, потребности и интересы, направленность и способности во многом зависят от того, в каких условиях протекает их формирование в детстве и юношеские годы. Выделяются три фактора, влияющие на развитие человека: наследственность, среда и воспитание. Развитие – это ...
Формирование навыков учебной деятельности
Усвоение детьми программного материала в большей мере определяется работой, направленной на формирование навыков учебной деятельности. Важно с первых занятий развивать у ребят умение заниматься, систематически приучать к внимательному наблюдению за действиями педагога и одновременному слушанию его ...
Индивидуально – дифференцированный подход на основе состояния здоровья
детей
На основе состояния здоровья дети делятся по медицинским группам, что способствует определению для каждой из них оптимальной физической нагрузки и условий физического воспитания. Первую группу здоровья составляют дети с нормальным уровнем физического развития и основных функций организма. Ко второй ...
Педагогика как наука

Обучение было и всегда будет, пока живет человечество. Можно сказать, что подготовка молодого поколения к участию в жизни общества путем передачи социального опыта есть неотъемлемая общественная функция во все времена и у всех народов.
Категории
- Главная
- Методы производственного обучения
- Новые технологии обучения
- Обучение чтению на начальном этапе
- Сущность воспитания
- Информатика и образование
- Формирование деятельности
- Карта сайта
