История развития оценочной системы
Учитывая, что электроны могут обладать противоположными (антипараллельными) спинами, их может быть в атомах от одного до десяти. Электроны с такой формой облаков называются d-электронами. Следовательно, на третьем энергетическом уровне может разместиться два s-электрона, шесть p-электронов и десять d-электронов, т.е. всего восемнадцать электронов.
Положение в периодической системе химических элементов Д.И. Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов
Положение водорода в периодической системе химических элементов Д.И. Менделеева. Вы, вероятно, заметили, что химический знак водорода обычно помещен и в главной подгруппе I, и в главной подгруппе VII группы. Возникает вопрос: почему это так? Чтобы ответить на него, вспомним основные химические свойства простого вещества водорода.
Водород является восстановителем, т.е. донором электронов.
Учитывая аналогию свойств водорода и элементов металлического характера, химический знак водорода помещают в главной подгруппе I группы.
Однако водород реагирует и с металлическими элементами главной подгруппы I группы. В этих реакциях водород проявляет окислительные свойства и приобретает степень окисления -1.
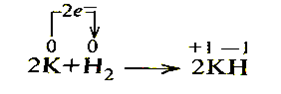
На основе этого химический знак водорода помещают в главную подгруппу VII группы. Так как для водорода более характерны восстановительные свойства, чем окислительные, его химический символ в VII группе обычно пишут в скобках.
Положение лантаноидов и актиноидов в периодической системе химических элементов Д.И. Менделеева. К лантаноидам относятся четырнадцать химических элементов – от церия Ce до лютеция Lu (порядковые номера 58–71). Так как в их атомах содержатся f-электроны, лантаноиды относятся к f-элементам.
В свободном состоянии лантаноиды – типичные металлы. К актиноидам относятся четырнадцать химических элементов – от тория Th до лоуренсия Lr (порядковые номера 90–103). Так как в атомах этих элементов также присутствуют f-электроны, то актиноиды, как и лантаноиды, относятся к f-элементам.
Как и в случае лантаноидов, у атомов элементов семейства актиноидов происходит заполнение третьего снаружи энергетического уровня (5 f-подуровня). Строение же наружного и, как правило, предшествующего электронных уровней остается неизменным. Поэтому лантаноиды сходны по химическим свойствам.
Все актиноиды радиоактивны. Торий Th, протактиний Pa и уран U встречаются в природе в виде изотопов с большим периодом полураспада. Остальные актиноиды в основном поучены искусственным путем.
Уран U, плутоний Pu и некоторые другие актиноиды используются для получения ядерной энергии.
Химические знаки лантаноидов и актиноидов обычно помещают в два ряда в периодической системе под группами химических элементов.
Искусственно получаемые химические элементы образуются в ядерных реакциях. В таблице периодической системы химических элементов Д.И. Менделеева они помещены в соответствии с электронным строением их атомов.
Валентность и валентные возможности атомов
Понятие «Валентность» относится к важным понятиям химии. Слово «валентность» (от лат. «valentia») возникло в середине ХІХ в. в период завершения химико-аналитического этапа развития химии. В настоящее время валентность химических элементов принято определять числом ковалентных связей, которыми данный атом соединен с другими атомами.
Валентность – это способность атома химического элемента образовывать определенные число химических связей.
Валентность – способность атомов одного элемента присоединять определенное количество атомов другого элемента.
Валентность и валентные возможности – важные характеристики химического элемента. Они определяются структурой атомов и периодически изменяются с увеличением зарядов ядер.
Что по вашему означает понятие валентность? (мнение учащихся). Валентность, значит возможность – средство, условие, необходимое для осуществления чего-нибудь; возможный – такой, который может произойти, допустимый.
Валентные возможности атомов – это допустимые валентности элемента, весь спектр их значений в различных соединениях.
Поскольку валентность атома зависит от числа неспаренных электронов, рассмотрим структуры атомов в возбужденных состояниях учитывая валентные возможности. Запишем электронографические формулы распределения электронов по орбиталям в атоме углерода. С их помощью определим, какую валентность проявляет углерод С в соединениях. Звездочкой (*) обозначают атом в возбужденном состоянии:
Еще по теме:
Состояние дошкольного образования в России
Дошкольное воспитание как первая ступень образования, на которой закладываются основы социальной личности и важнейший институт поддержки семьи за последние 10 лет прошло сложный путь вписывания в новые реалии. Первоначальное резкое сокращение охвата детей дошкольным воспитанием к 1995 году стабилиз ...
Особенности воспитания в родительских и опекунских семьях
умственно отсталых детей
Основным значимым элементом, взятым из внешней среды ребенком, является мать или заменяющий её человек. В большинстве родители, переживая кризис, связанный с рождением неполноценного ребенка эмоционально отвергают его, проявляют нетерпение и раздражение в общении с ребенком, нарушая, таким образом, ...
Содержание и этапы эмпирического исследования проявления согласованных
действий у детей шестого года жизни в процессе строительной игры
Для изучения особенности проявления согласованных действий у детей шестого года жизни в процессе строительной игры мы провели исследование на базе МДОУ детский сад комбинированного вида 131 г. Комсомольска–на-Амуре. В исследовании участвовало 40 детей шестого года жизни. Были определены две группы ...
Педагогика как наука

Обучение было и всегда будет, пока живет человечество. Можно сказать, что подготовка молодого поколения к участию в жизни общества путем передачи социального опыта есть неотъемлемая общественная функция во все времена и у всех народов.
Категории
- Главная
- Методы производственного обучения
- Новые технологии обучения
- Обучение чтению на начальном этапе
- Сущность воспитания
- Информатика и образование
- Формирование деятельности
- Карта сайта
