Разработка учебных занятий в средней и высшей школе
Запасные функции. В растениях содержатся запасные белки, являющиеся ценными пищевыми веществами. В организмах животных мышечные белки служат резервными питательными веществами, которые мобилизуются при крайней необходимости.
В настоящее время различают первичную, вторичную и третичную структуры белковой молекулы.
Первичная структура белка – его химическая структура, т.е. последовательность чередования аминокислотных остатков в полипептидной цепи данного белка.
Вторичная структура белка – форма полипептидной цепи в пространстве. Установлено, что полипептидные цепи природных белков находятся в скрученном состоянии – в виде спирали. Спиральная структура удерживается водородными связями, возникающими между группами СО и NH аминокислотных остатков соседних витков спирали. Подобная вторичная структура получила название a-спирали. Водородные связи в ней направлены параллельно длинной оси спирали (a-спирали чередуются с аморфными частями). Такое представление является общепризнанным. Вытянутые полипептидные цепи имеет лишь небольшое число белков, например, белок натурального шелка – фиброин, вязкая сиропообразная жидкость, затвердевающая на воздухе в прочную нерастворимую нить.
Третичная структура белка – реальная трехмерная конфигурация, которая принимает в пространстве закрученная спираль полипептидной цепи. В простейших случаях третичную структуру можно представить как спираль, которая в свою очередь свернута спиралью. У такой структуры в пространстве имеются выступы и впадины с обращенными наружу функциональными группами. Третичной структурой объясняется специфичность белковой молекулы, ее биологическая активность. Определяющими факторами образования и удержания третичной структуры белков являются связи между боковыми радикалами аминокислотных остатков (дисульфидные мостики атомов серы, солевые мостики из аминогруппы и карбоксила, водородные мостики)
Физические и химические свойства белков
Строением белков объясняются их весьма разнообразные свойства. Они имеют разную растворимость: некоторые растворяются в воде, другие – в разбавленных растворах нейтральных солей, а некоторые совсем не обладают свойством растворимости (например, белки покровных тканей). При растворении белков в воде образуется своеобразная молекулярно-дисперсная система (раствор высокомолекулярного вещества). Некоторые белки могут быть выделены в виде кристаллов (белок гемоглобина крови).
Химические свойства
1) Подобно аминокислотам, белки проявляют амфотерные свойства. При действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи, образуя соль альбуминат:
![]()
2) При действии же кислот он становится катионом, образуя синтонин:
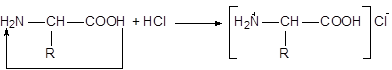
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, - свойства оснований. Присутствие белка можно обнаружить рядом цветных реакций. Эти реакции свойственны составным частям белка – аминокислотам или образуемым ими группировкам.
3) Биуретовая реакция (реакция на наличие пептидных связей). Биурет образуется при нагревании мочевины с отщеплением от нее аммиака:
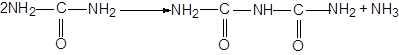
4) Нингидриновая реакция.
Эта реакция характерна для аминогруппы в a-положении. Белки с нингидрином дают синее или фиолетовое окрашивание:
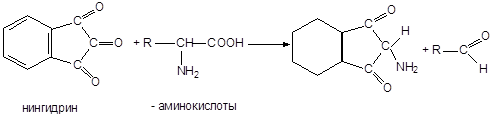
5) Ксантопротеиновая реакция.
Эта реакция характерна для бензольного ядра циклических аминокислот. При действии крепкой азотной кислоты на эти аминокислоты происходит нитрование кольца с образованием нитросоединений желтого цвета [48, 49].
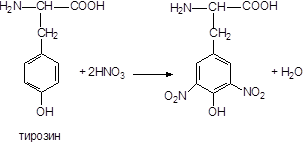
2. К белковым веществам относятся ферменты, или энзимы, выполняющие в живом организме функцию катализаторов высокой селективности и при очень мягких условиях. Это избирательное действие обусловлено комплиментарностью структур реагирующего субстрата и фермента — тем, что заряд или выступающая группа на поверхности одного из них отвечает противоположному заряду или полости у другого (принцип «ключа к замку» — см. рис. 12). Вследствие этого молекулы фермента и субстрата настолько сближаются, что резко возрастает эффективность межмолекулярных сил, противостоящих тенденции молекулярно-кинетического движения разъединить взаимодействующие частицы, происходит специфическая адсорбция (образование фермент-субстратного комплекса). Те же силы могут играть существенную роль в самом возникновении структурного соответствия между субстратом и ферментом.
Еще по теме:
Растения: разновидности и уход
В уголке живой природы хорошо приживаются обитатели тропических лесов и болот: бегония, бальзамин, фикус, традесканция; выносливые растения пустынь: амариллис, кливия, кринум, алоэ, филлокактус, хлорофитум; некоторые субтропические: герань, аспидистра. Эти комнатные растения украшают помещения и в ...
Сущность понятия «мотивация»
Мотивация – это стремление учащихся к знаниям, личностному самосовершенствованию и саморазвитию, присвоению нового опыта и укреплению полученных навыков. Очевидно, что процесс получения полноценного образования невозможен без мотивации учащихся. Мотивация и интерес студентов к самостоятельной работ ...
Содержание и роль линии уравнений и неравенств в
современном школьном курсе математики
Ввиду важности и обширности материала, связанного с понятием уравнения, его изучение в современной методике математики организовано в содержательно-методическую линию уравнений и неравенств. Здесь рассматриваются вопросы формирования понятий уравнения и неравенства, общих и частных методов их решен ...
Педагогика как наука

Обучение было и всегда будет, пока живет человечество. Можно сказать, что подготовка молодого поколения к участию в жизни общества путем передачи социального опыта есть неотъемлемая общественная функция во все времена и у всех народов.
Категории
- Главная
- Методы производственного обучения
- Новые технологии обучения
- Обучение чтению на начальном этапе
- Сущность воспитания
- Информатика и образование
- Формирование деятельности
- Карта сайта
